蛋白磷酸化是真核細胞普遍的翻譯后修飾形式����,在細胞信號轉(zhuǎn)導(dǎo),細胞過程以及蛋白質(zhì)功能調(diào)控方面發(fā)揮著重要作用�����。蛋白磷酸化是通過蛋白激酶將三磷酸腺苷(ATP)末端磷酸基團轉(zhuǎn)移到底物蛋白的絲氨酸��、蘇氨酸和酪氨酸殘基上。蛋白激酶的基因突變或異常表達引起激酶過度激活����,從而引發(fā)癌癥及其他疾病�����。因此�����,蛋白激酶已成為最重要的抗腫瘤藥物靶點之一。目前�����,全球有80余種激酶抑制劑(PKI)獲批上市,還有約180種PKI正在進行臨床試驗����。盡管如此�,PKI藥物的研發(fā)仍面臨諸多挑戰(zhàn),特別是靶點選擇性以及脫靶毒性���。目前,PKI的選擇性評價主要依賴于數(shù)百種克隆純化的蛋白激酶���,或轉(zhuǎn)基因高表達目標激酶的細胞系。純化的激酶因脫離細胞環(huán)境���,無法真實反映PKI在細胞內(nèi)的選擇性;而轉(zhuǎn)基因細胞的測試僅限于預(yù)先設(shè)定的目標激酶����。針對這一問題,中國科學(xué)院上海有機化學(xué)研究所生命過程小分子調(diào)控全國重點實驗室康經(jīng)武課題組發(fā)展了一種超深度磷酸化蛋白質(zhì)組學(xué)方法�����,實現(xiàn)了在細胞水平和蛋白組學(xué)層面對PKI選擇性的全面評價。
蛋白磷酸化具有高度動態(tài)和低豐度的特點(磷酸化蛋白質(zhì)組僅占總蛋白質(zhì)組的0.1%�����,而酪氨酸磷酸化蛋白僅占磷酸化蛋白質(zhì)組的 0.1-1%),因此��,磷酸化肽段的富集成為質(zhì)譜分析的關(guān)鍵步驟�����。為了精確測量PKI引起的磷酸化事件�����,在他們發(fā)展的系列微型整體親和色譜柱技術(shù)的基礎(chǔ)上(Anal Chem 2020���,92����,3913-3922,J Proteome Res 2023�����,22����,2450-2459,Anal. Chem. 2023, 95, 8605-8612)�,提出了一種集成三種選擇性互補的磷酸化肽段富集材料的策略,實現(xiàn)了對磷酸化肽段的深度全覆蓋和無偏倚的定量分析(圖1)����。
圖1. 超深度磷酸化蛋白組分析流程示意圖和磷酸化蛋白組分析數(shù)據(jù)輪廓(點擊查看大圖)
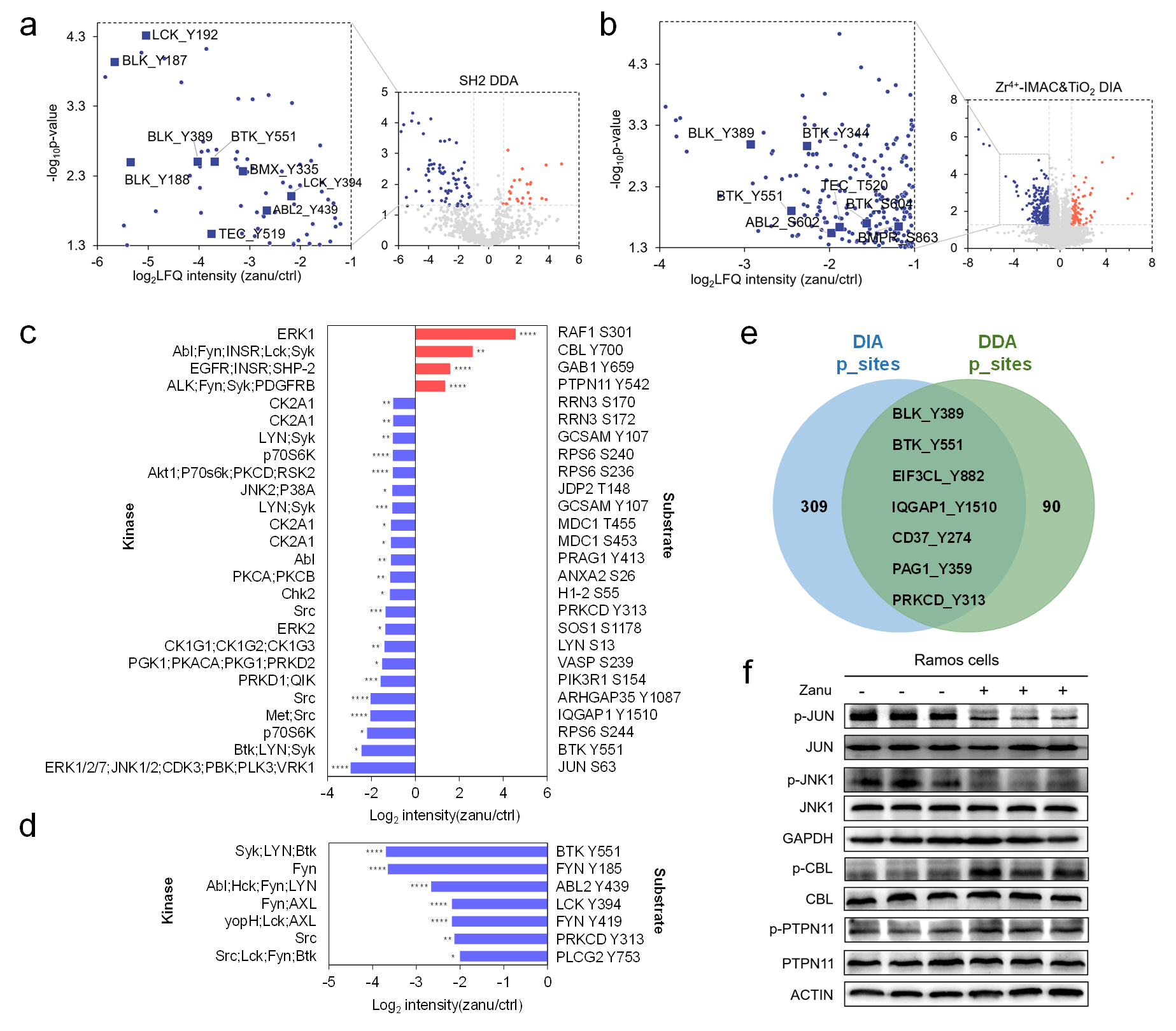
以澤布替尼為模型,在數(shù)據(jù)依賴性質(zhì)譜采集(DDA)數(shù)據(jù)中�����,檢測到25種蛋白質(zhì)的25個磷酸化位點的磷酸化水平顯著上調(diào)��,66種蛋白質(zhì)的72個磷酸化位點的磷酸化水平顯著下調(diào)(其中酪氨酸磷酸化占比為80.9%);在數(shù)據(jù)非依賴性質(zhì)譜采集(DIA)數(shù)據(jù)中�����,檢測到有80種蛋白質(zhì)的91個磷酸化位點的磷酸化水平顯著上調(diào)���,167種蛋白質(zhì)的的磷酸化水平顯著下調(diào)(絕大部分為絲氨酸/蘇氨酸磷酸化位點)(圖2)��。
圖2. 超深度磷酸化蛋白組學(xué)分析揭示澤布替尼引起的B細胞淋巴瘤細胞的磷酸化事件變化(點擊查看大圖)
圖3.澤布替尼抑制或激活的蛋白激酶及其參與的細胞過程
(點擊查看大圖)
生物信息學(xué)富集分析表明��,除了抑制BCR和FcR信號通路外����,澤布替尼還調(diào)控了B細胞凋亡���、EGFR、ERBB�、RPTK以及MAPK級聯(lián)等信號通路(圖3)。非常有意思的是���,他們的研究發(fā)現(xiàn)澤布替尼不僅抑制了BTK及其下游多個關(guān)鍵的信號通路���,還上調(diào)了RAF1���、CBL和PTPN11蛋白的磷酸化水平,進而激活了ERK1/2 MAPK介導(dǎo)的BCR信號通路負反饋調(diào)控�,在BCR信號通路上游阻斷信號轉(zhuǎn)導(dǎo)���。與文獻報道的澤布替尼的靶點相比����,他們發(fā)展的超深度的磷酸化蛋白組學(xué)策略能夠在活細胞水平�����,以高通量的方式獲得更豐富的作用靶標(或脫靶)信息����。通過將磷酸化事件映射到細胞信號通路中,可以全景式地揭示澤布替尼的作用機制(圖4)。
圖4. 通過超深度磷酸化蛋白組學(xué)揭示的澤布替尼可能的分子藥理學(xué)機制(點擊查看大圖)
總之�����,超深度磷酸化蛋白組學(xué)分析不僅能以高通量��、高靈敏和高置信度的方式在細胞水平全面評價蛋白激酶抑制劑的選擇性,還能通過分析藥物引起的磷酸化級聯(lián)反應(yīng)����,揭示PKI更精細的作用機理����。此外,這一技術(shù)還可廣泛用于細胞生物學(xué)的信號轉(zhuǎn)導(dǎo)研究����。中國科學(xué)院上海有機化學(xué)研究所博士生張越為論文第一作者�,中國科學(xué)院上海有機化學(xué)研究所生物康經(jīng)武研究員和上??萍即髮W(xué)組學(xué)分析平臺的郝丕良研究員為共同通訊作者。感謝賽默飛科技有限公司在Astral分析上的幫助��。該工作得到了國家自然科學(xué)基金委�、中國科學(xué)院及上海市科委等項目及基金的資助�。